某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH
 ()。
()。
(2)反应
 中的还原剂为()。
中的还原剂为()。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和
 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
假设1:只存在
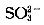 ;假设2:既不存在
;假设2:既不存在
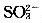 ,也不存在ClO-;假设3:()。
,也不存在ClO-;假设3:()。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3mol·L-1H2SO4、1mol·L-1NaOH、0.01mol·L-1KMnO4、淀粉—KI溶液、紫色石蕊溶液。

参考答案:
(1)Na2SO3+H2O
(2)Na2SO3
(3)①只存在ClO-
②
解析:
(2)由元素化合价的变化可知Na2SO3是还原剂。(3)由(2)小题中化学方程式可知,当Cl2少量时,溶液中还可能有;当Cl2与Na2SO3恰好完全反应时,溶液中既无也无ClO-;当Cl2过量时,溶液中可能有ClO-,故假设3是只存在ClO-。探究ClO-是否存在时,可利用SO2的还原性及HClO的氧化性进行实验检验。
