(15分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) ▲ 。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
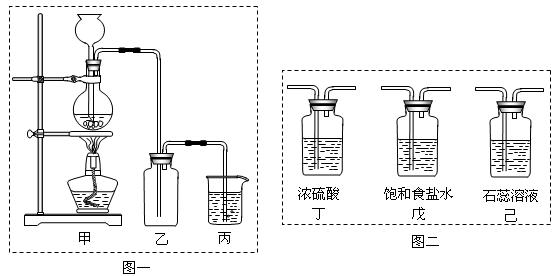
(1)指出图一装置中的错误之处 ▲ , ▲
(2)丙装置的作用 ▲ 。丙装置中发生反应的离子方程式 ▲ 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: ▲ 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
▲ 。
A.NaBiO3
B.FeCl3
C.PbO2
D.Na2O2已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
▲ 。为什么? ▲ 。
(15分)反应原理为:2NaCl + 2H2O 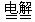 2NaOH + H2↑ +Cl2↑(2分)
2NaOH + H2↑ +Cl2↑(2分)
(1)未用石棉网(1分) ,用长颈漏斗而未用分液漏斗(1分);
(2)吸收多余氯气,防止环境污染(2分)。Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)甲戊丁乙丙(2分)
(4) AC (2分,少选给1分,错选不给分)
(5)不对(1分),石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2(2分)
