用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
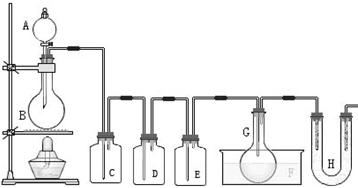
请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是 。
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,反应的化学方程式为___________________________________ 。
(3)若发现C中气泡产生过猛,需要进行的操作或对装置进行的改进是 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是 ;从PCl3和PCl5的混合物中分离出PCl3的方法是 (选填序号)。
a.蒸馏 b.过滤 c.分液 d.升华
(5)生成的PCl3在G中收集 ,则F中盛有 ,作用是______________________。
,则F中盛有 ,作用是______________________。
(6)C、D、H所盛的试剂分别是(选填序号):C ; D ; H 。
a.饱和食盐水 b.浓硫酸 c.无水氯化钙 d.碱石灰
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是 。
(12分,每空1分)
(1)H接一导管放入水槽,微热圆底烧瓶,盛液体的仪器中产生气泡 ,撤灯后导管中形成水注,说明装置气密性良好。
,撤灯后导管中形成水注,说明装置气密性良好。
(2)浓盐酸,MnO4 + 4HCl (浓) MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(3)用分液漏斗控制添加液体的量(合理即可)
(4)P过量生成PCl3,氯气过量生成PCl5;a 。(5)冷水, 使得三氯化磷液化
(6)a; b; d
(7)PCl5(可能还有P2O5)蒸 气冷却后变成固体。
气冷却后变成固体。
