(12分)实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气。某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下(部分导管、蒸馏水略):
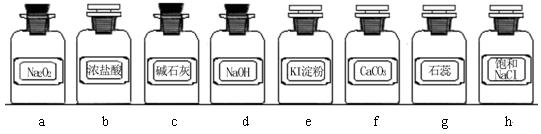

(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_________________________。
(2)下列装置组合最合理的是__________ (填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③、⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④、⑥ | ⑤ | ⑧/g | ① |
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ___________________________________,② ___________________________________。
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?___________(填“是”或“否”);理由是__________________________________________ 。
(12分)
(1)Na2O2+4HCl=2NaCl+Cl2↑+2H2O(2分)
(2)D(4分,若选B,得2分)
(3)2Na2O2+2H2O=4NaOH+O2↑(或4Na2O2+4HCl=4NaCl +2H2O+ O2↑)(2分)。
(4)① Na2O2能与水反应,会使原料的利用率降低 (1分)。
②双氧水比Na2O2更经济(1分)。
③产生等量的Cl2,用双氧水消耗的盐酸的量少。
④ Na2O2能与水反应,生成的NaOH能与盐酸反应。
⑤ Na2O2能与水反应,生成的NaOH吸收了Cl2
(以上任两点即可,凡合理答案均可,每空1分)
(5)否(1分), 产物不纯且难以分离(1分)。
