(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
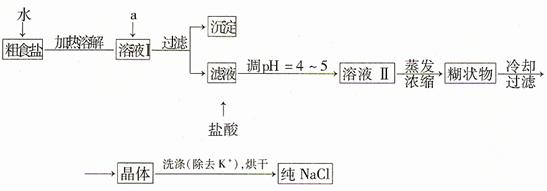
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要 (填仪器名称);若定容时仰视刻度线,则所配溶液的浓度 (填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为 ,同样条件下收集的Cl2 (填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为: ;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置 (填代号)
可选用制备气体的装置:
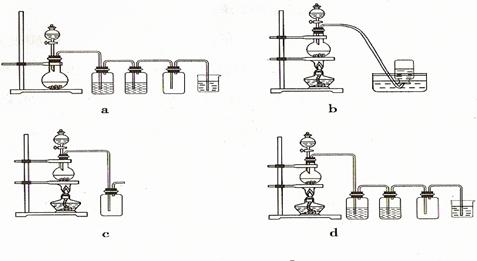
所选装置中的两个洗气瓶里应依次盛装 、 (填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由 ;尾气用 溶液(填化学式)吸收,写出发生反应的离子方程式 。
(16分)
(1) BaCl2、NaOH 、Na2CO3(2分,其他合理顺序也给分)
(2)500 mL的容量瓶、胶头滴管(2分,写与不写“量筒”均不扣分)
偏小(1分)
(3)0.3NA或1.806×1023(1分 )
< (1分)
(4)MnO2+4H++2Cl-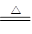 Mn2++Cl2↑+2H2O(2分 )
Mn2++Cl2↑+2H2O(2分 )
d (1分 )
饱和食盐水或饱和的氯化钠溶液、浓硫酸(2分 )
Cl2溶于水并与水发生反应Cl2 +H2O 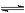 H++Cl—+HClO,增大Cl—的浓度使平衡向左移动,有利于收集更多的氯气 (2分 ) NaOH (1分 ) Cl-+2OH-=Cl-+ClO-+H2O(2分 )
H++Cl—+HClO,增大Cl—的浓度使平衡向左移动,有利于收集更多的氯气 (2分 ) NaOH (1分 ) Cl-+2OH-=Cl-+ClO-+H2O(2分 )
