A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A原子核外K层电子数为奇数,且A与C同主族;B原子最外层电子数占核外电子总数的
,D原子的最外层电子数与最内层电子数恰好相等,E原子最外层电子数比D原子最外层电子数多5.请回答下列问题:3 4
(1)写出下列元素的符号:C______,E______.
(2)由A、B、C三元素所形成的化合物的电子式为______,其晶体中所含化学键的类型有______.在周期表内与B同族的元素(用R表示)与A形成的化合物A2R中,A2B的沸点是最高的,其原因是______.
(3)写出D的最高价氧化物对应水化物与E的最高价氧化物对应水化物反应的离子方程式______.
(4)由D单质参与的置换反应中,另一种单质对应元素的原子序数D元素的一半.写出该置换反应______.
A原子核外K层电子数为奇数,则A为H元素,B原子最外层电子数占核外电子总数的
,则最外层电子数应为6,核外电子总数为8,应为O元素,A与C同主族,且C的原子序数大于B,则C为Na元素,D原子的最外层电子数与最内层电子数恰好相等,则应为Mg元素,E原子最外层电子数比D原子最外层电子数多5,则最外层电子数为7,且原子序数最大,应为Cl元素,3 4
(1)由以上分析可知,C为Na元素,E为Cl元素,故答案为:Na;C1;
(2)A、B、C三元素所形成的化合物为NaOH,为离子化合物,含有离子键,O与H原子间为共价键,电子式为
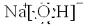
,
故答案为:
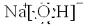
; 离子键和共价键; 分子间存在氢键;
(3)D为Mg元素,对应的最高价氧化物对应水化物为Mg(OH)2,难溶于水,
E为Cl元素,对应的最高价氧化物对应水化物为HClO4,为强酸,
则二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(4)由D单质参与的置换反应中,另一种单质对应元素的原子序数D元素的一半,则该元素的原子序数为6,应为C元素,该反应为Mg在CO2中的燃烧反应,
反应的化学方程式为2Mg+CO2
2MgO+C,故答案为:2Mg+CO2 点燃 .
2MgO+C. 点燃 .
