(10分)常温下,某工厂以浓硫酸、浓硝酸、粗铜、水和空气为原料,设计如图所示制取硫酸铜晶体(CuSO4·5H2O)的生产工序和流程。
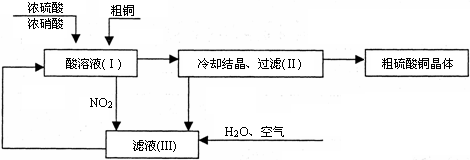
回答下列问题:
(1)(I)中制取硫酸铜的总反应的化学方程式为 。
(2)在上述反应中可以被循环利用的物质为 (写化学式)。
(3)①某同学在实验室中模拟上述生产过程实现上述方案,请根据该同学的思路在下列装置中选用适当的装置,并将它们的编号填入方框内。
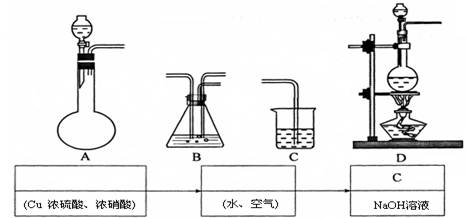
②装置C的作用是 。
(4)硫酸铜晶体也可以直接用浓硫酸和粗铜反应制取,与上述方法相比,其缺点是 。
(1)Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O (2分)
(2)HNO3答NO2也应给分 (2分)
(3)①A B (2分)
②吸收剩余的NO2 (2分)
(4)浓硫酸与Cu直接反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用原料利用率低并污染空气。
(1)Cu与HNO3(浓)反应,只有2molHNO3被还原,另2molH+ 由H2SO4提供,Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O; (2)HNO3答NO2也应给分(3)①铜与浓硝酸反应,不要加热,故选A,反应中要被充空气,选 B②装置C的作用是吸收剩余的NO2,防止污染空气(4)浓硫酸与Cu直接反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用原料利用率低并污染空气。
