(8分)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。
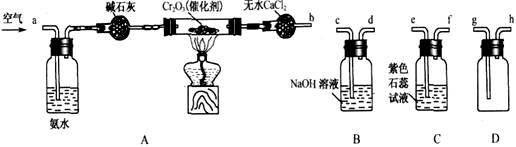
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________;
(3)进行实验时,装置A中碱石灰的作用是_____________,D中的现象是_______________;
(4)能证明有硝酸生成的现象是__________________________________________;
(5)实验开始时,下列操作顺序最合理的是______________
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
(1)b接( g ),( h )接( e ),( f )接( c )。(2分)
(2)4NH3+5O2 4NO+6H2O(2分)
4NO+6H2O(2分)
(3)吸收反应物中的水,防止反应温度降低(1分) ,气体由无色变为红棕色(1分)
(4)C中溶液由紫色变为红色(1分) (5)a (1分)
工业上通过氨气的催化氧化制取NO,再连续氧化可得到硝酸;综合实验目的及所给装置可判定,空气通过氨水后,经碱石灰干燥吸水,可防止催化氧化时温度降低,保证了氧化的条件;反应后的混合气体用CaCl2吸收氨气,NO进入D集气瓶,与氧气生成NO2,再通入紫色石蕊试液中,遇水可生成硝酸,同时可观察到溶液由紫色转变为红色;
由于反应中有氮的氧化物生成,会污染空气,最后应通入装置B中进行尾气的吸收
为了保证催化剂的活性,减小原料的浪费,应先加热A装置中的催化剂.再由导管a通入空气
