现有A、B、D、E、G原子序数依次增大的五种短周期元素,其中A的原子半径与G的原子半径之比最小,B、D、E三种元素原子的电子层数相同,同一周期中B的一种单质的熔点最高,E与A、B、D、G均能形成多种常见化合物.
(1)BE2的电子式是______.
(2)实验室制取B2A2的化学方程式是:______
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,仅用一个化学方程式表示甲既有氧化性又有还原性:______.
(4)电解质乙和丙由上述元素中的几种组成,l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则丙中的化学键类型有______,乙的电离方程式是______.
(5)由A、B两元素形成的含18个电子的气态化合物,该化合物与氧气和KOH溶液可构成燃料电池,写出该燃料电池负极电极反应式:______.
A、B、D、E、G原子序数依次增大的五种短周期元素,A的原子半径与G的原子半径之比最小,则A为H元素;B、D、E三种元素原子的电子层数相同,同一周期中B的一种单质的熔点最高,则B为C,E与A、B、D、G均能形成多种常见化合物,则E为O,所以D为N;G与氧形成氧化钠、过氧化钠,所以G为Na,
(1)BE2为CO2,其电子式为
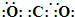
,故答案为:
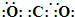
;
(2)B2A2为C2H2,实验室利用碳化钙与水反应制备乙炔,反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,则甲为过氧化氢,分解时既有氧化性又有还原性,
该反应为2H2O2
2H2O+O2↑,故答案为:2H2O2 MnO2 .
2H2O+O2↑; MnO2 .
(4)l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则乙为NH3?H2O,其电离方程式为NH3?H2O
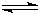
NH4++OH-,
丙为NaOH,NaOH中含有离子键,极性共价健,故答案为:离子键,极性共价健;NH3?H2O
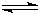
NH4++OH-;
(5)A、B两元素形成的含18个电子的气态化合物为C2H6,在碱性电池中为负极,负极反应为
C2H6-14e-+180H-=2CO32-+12H2O,
故答案为:C2H6-14e-+180H-=2CO32-+12H2O.
