(14分)某学校研究性学习小组利用实验室常用试剂,
探究硝酸的氧化性。请完成下面的空白:
(1)在具支试管底部滴入5滴浓硝酸,然后用硫化 亚铁与盐酸反应制备H2S气体,如图所示通入具支试管中,可以观察到在试管内形成黄烟,黄烟附着在试管内壁上,形成“黄霜”。

出上述制备H2S的离子方程式
______________________________________。
②在试管内壁上的“黄霜”的成分是_______________,该反应说明浓硝酸有氧化性外,实验现象还说明了浓硝酸具有________性。该实验中烧杯内的氢氧化钠溶液的作用是
__________________________________________________________________。
(2)卤族元素单质也具有氧化性,该小组设计了下面的实验探究碘单质与稀硝酸氧化性强弱比较:
①提出合理的假设
假设l:碘单质氧化性强于稀硝酸;假设2:碘单质氧化性弱于稀硝酸。
②设计实验方案,进行实验探究,请写出实验步骤和预期的现象与结论。限选实验试剂与仪器:稀硝酸、KI溶液、四氯化碳;试管、胶头滴管。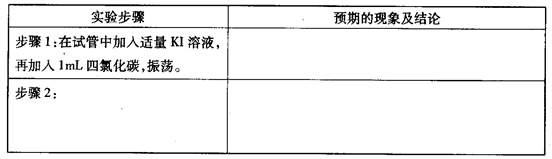
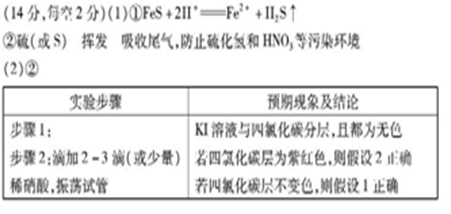
1、(1)实验室里通常用黑色难溶于水的FeS固体与稀盐酸(或稀硫酸)反应制H2S。其化学反应方程式为:FeS + 2HCL == FeCL2 + H2S↑,根据离子方程式的书写原则,该反应的离子方程式为:FeS + 2H+== Fe2+ + H2S↑;
(2)H2S具较强的还原性,属于还原性气体;浓HNO3具有强氧化性;当H2S气体通入浓HNO3时,两者会发生氧化还原反应,其反应的化学方程式为:
H2S + 2HNO3 (浓===== S↓+2 NO2↑+2 H2O,由于反应放热,且S的沸点比较低,再加上浓硝酸具有挥发性,所以观察到的“黄霜”成分为S。由于反应后生成了NO2气体且多余的H2S气体都属于大气的污染物,所以要用NaOH溶液吸收尾气,防止污染大气。
2、CCL4是一种无色油状液体,不溶于水,且密度大于水;加入KI溶液(无色),会分层,CCL4在液体的下层,KI溶液在上层。
当往试管中滴加少量稀HNO3后,若稀HNO3的氧化性强于I2的氧化性,就能将KI溶液中的I-氧化为I2,而I2在CCL4中的溶解度远大于其在水中的溶解度,所以将会出现下层无色的CCL4液体成为紫红色的碘的四氯化碳溶液,而上层KI溶液则仍为无色。则假设2正确;若稀HNO3的氧化性弱于I2的氧化性,根据氧化还原反应的基本规律,则不会发生反应,也就没有碘单质生成了,四氯化层仍为无色液体。则假设1正确。
