已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则:
(1)A、B、C、D、E、F的名称分别是______.
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式______,写出一种含非极性键的离子化合物的电子式______.
(3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是______,该物质与E的同周期相邻主族元素的单质反应的化学方程式为______
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为______.
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式______.
(3)A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍v3,则E的原子序数为33,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素,
所以A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯,
故答案为:氢、碳、氮、氧、钠、氯;
(2)在A至F中任选元素,含极性键的非极性分子有等CO2、CH4、CCl4,对应结构式分别为O=C=O、
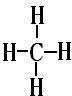
、
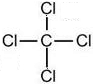
,含非极性键的离子化合物为Na2O2,电子式为
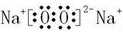
,
故答案为:O=C=O、
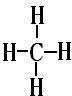
、

(任写两种);
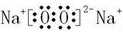
;
(3)由C和O组成,且C和O的质量比为3:个的化合物为CO2,电子式为

,与Na的同周期相邻主族元素为Mg,二者反应的化学方程式为CO2+2Mg
C+2MgO, 点燃 .
故答案为:

;CO2+2Mg
C+2MgO; 点燃 .
(4)Cl2与NaOH溶液反应生成NaClO和水,反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(a)n(CH4)=
=个.amol,完全燃烧后恢复到室温,放出热量a kJ,则3mol完全燃烧放出2akJ热量,所以表示CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol,个g 36g/mol
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol.
