(9)某化学兴趣小组用铜和浓硫酸制取SO2,并检验SO2的性质,实验装置如下图所示:
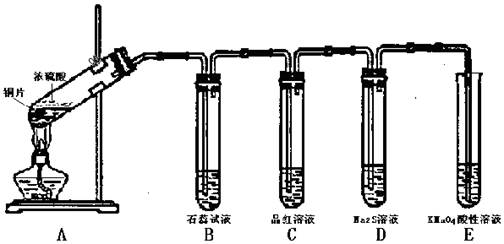
已知酸性KMnO4溶液具有强氧化性,许多气体能够使酸性KMnO4溶液褪色。请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)装置B中的现象是 ,装置D中的现象是 。
(3)分析实验意图,装置C证明SO2具有 性,装置E能够起到的两个作用是:
、 。
(4)实验过程中还观察到A试管内产生黑色沉淀,黑色沉淀是副反应产物,可能是CuO、CuS和Cu2S.已知CuS和Cu2S均不溶于盐酸、硫酸。如何用化学方法证明黑色沉淀中没有CuO? 。
(9分) (1) Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O (2分)
CuSO4+SO2↑+2H2O (2分)
(2)溶液变红(或溶液由紫色变为红色) (1分) 溶液浑浊(或产生浅黄色沉淀,或产生乳白色沉淀) (1分)
(3)漂白 (1分) 证明SO2具有还原性(1分) 吸收尾气(1分)
(4)将黑色沉淀用水洗净后加入稀盐酸(或稀硫酸)中,不能得到蓝色溶液,则表明黑色沉淀
中无CuO。(2分)
(1)A中浓硫酸与铜反应的化学方程式为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)二氧化硫通入石蕊试液中先与水反应生成亚硫酸,是溶液呈酸性石蕊试液变为红色,二氧化硫与硫化钠反应生成硫单质,难溶于水,所以D中的现象是溶液产生了浑浊。
(3)二氧化硫使品红褪色是因为二氧化硫具有漂白性,二氧化硫与酸性高锰酸钾反应说明二氧化硫具有还原性,同时还可以除去二氧化硫以免污染环境,实现尾气处理。
(4)由于CuS和Cu2S均不溶于盐酸、硫酸,所以可以取少量的黑色沉淀洗净后加入稀硫酸若沉淀都不溶解并且无蓝色溶液产生说明其中没有氧化铜。
