某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
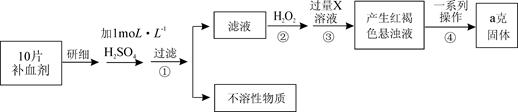
请回答下列问题:
Ⅰ.(1)实验时用18.4 mol·L-1的浓硫酸,配制100 mL 1 mol·L-1 H2SO4溶液,所需浓硫酸的体积为 。(计算结果精确到小数点后一位)
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来溶解固体溶质 D.常用来代替量筒量取一定体积的液体
(3)在下列配制过程示意图中,有错误的是(填写序号) 。
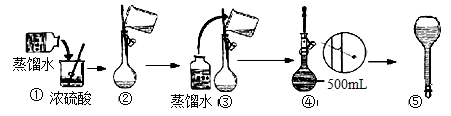
(4)下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
Ⅱ.(1)步骤②加入过量H2O2的目的: 。
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a. ,b. 洗涤,c. 灼烧,d. 冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为 。
Ⅲ.已知人体不能很好地吸收利用Fe3+,科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C,以利于铁元素的吸收。试分析维生素C在这一过程中的作用是 。
(14分)Ⅰ.(1)5.4 ml(2分)(2)A(1分)(3) ①④(2分) (4) AC(2分)
Ⅱ.(1)把亚铁离子全部氧化成铁离子(2分)(2)过滤(1分)(3)0.19ag (2分)
Ⅲ.作还原剂,防止Fe2+被氧化(2分)
Ⅰ.(1)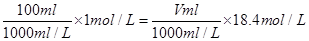 ,V=5.4 ml
,V=5.4 ml
(2)容量瓶只有一个功能:配制一定体积与浓度的溶液,选A
(3)浓硫酸的稀释错误:应将浓硫酸加入水中并不断的用玻璃棒搅拌;定容时眼睛的视线应与液面保持水平;选①④
(4)A.正确
B.浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,将使定容时加水偏少,所配溶液浓度会偏高
C.正确
D.查漏:在容量瓶内装入半瓶水,塞紧瓶塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立(瓶口朝下),观察容量瓶是否漏水。若不漏水,将瓶正立且将瓶塞旋转180°后,再次倒立,检查是否漏水,若两次操作,容量瓶瓶塞周围皆无水漏出,即表明容量瓶不漏水
Ⅱ.(1)加入双氧水的目的是将亚铁离子全部氧化成铁离子
(2)将沉淀分离一般采用过滤的方法,再洗涤、灼烧、冷却,称量
(3)由铁的守恒可知:2FeSO4~Fe2O3,Fe2O3的质量为ag,则FeSO4的质量为1.9ag,每片补血剂中含硫酸亚铁的质量为0.19ag
Ⅲ.由题意说明维生素C可还原氧气(或铁离子),具有还原性
