有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中:X、Z是金属元素;V和Z元素原子的最外层电子都只有一个,W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半,由此推知:
①写出V的元素符号,______.X的原子结构示意图______,这五种元素中,原子的还原性最强的是(写元素符号)______,原子氧化性最强的是(写元素符号)______,气态氢化物中稳定性较弱的是(写化学式)______.
②用电子式表示下列物质的形成过程:由V、W构成三原分子______,
Y、Z元素形成的化合物______.③X单质与Y的最高价氧化物反应的离子方程式______.
首先由W元素原子L层电子数是K层电子数的3倍,得知W是氧;由W和Y元素原子的最外层电子数相同,Y的核电荷数比W大,且都小于20,所以Y为硫;由Z的核电荷数比硫大,小于20,金属元素,Z元素原子的最外层电子只有一个,得知Z是钾;由X元素原子的最外层电子数是Y元素原子最外层电子数的一半,硫的核电荷数比X大,X的原子序数比氧大,所以X是铝;V元素原子的最外层电子只有一个,非金属元素,V的核电荷数比氧小,所以V是氢.
①因V是氢元素,所以元素符号为H;X是铝元素,它的原子结构示意图:
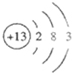
,根据元素周期律,可知还原性最强的元素在周期表的左下角,所以是K,还原性最强的元素在周期表的右上角,所以是O;
元素的非金属性越强,对应的氢化物的稳定性越大,非金属性Cl>O>S,所以氢化物的稳定性为:HCl>H2O>H2S,
故答案为:H;

;K;Cl;H2S.
②H2O是氢原子和氧原子通过共价键形成的极性分子,其形成过程是:

;
Y为硫,Z是钾,Y、Z元素形成的化合物K2S.故答案为:

;K2S.
③铝和硫酸发生置换反应是常显示+3价,产物是硫酸铝与氢气,方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑,
故答案为:2A1+6H+=2A13++3H2↑.
