(13分)某同学设计了如右下图的实验装置来粗略地测定电石中碳化钙的质量分数。
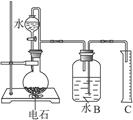
(1)烧瓶中发生反应的化学方程式为____________________________________________;装置B、C的作用是_________________________________,烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_________________________________。
(2)所用电石质量不能太大,否则_________________________________,也不能太小,否则 _________________________________;若容器B的容积为250 mL,则所用电石的质量应在___________ g左右(选填:0.03,0.60,1.00,1.50,2.00)。
(3)由分液漏斗往烧瓶里滴加水的操作方法是________________________________。
(4)实验中测得排入量筒中水的体积为V mL、电石的质量为W g,则电石中碳化钙的质量分数是___________%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计)。
(1)CaC2+2H2O C2H2↑+Ca(OH)2 2分
C2H2↑+Ca(OH)2 2分
B:贮水,以使烧瓶中产生的气体CH≡CH进入B时,排出与它等体积的水,进入量筒。C:测定乙炔的体积 2分
防止电石与残留的水作用,防止产生的乙炔逸散到大气中 1分
(2)产生乙炔太多超过B的容积,无法测定 2分
生成乙炔太少,测出体积数据小,误差大 2分
0.60 1分 (3)轻轻旋开活塞,使水缓慢滴下,直到不再产生气体为止 1分
(4)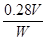 2分
2分
用电石和水制取乙炔,排水法收集气体,不可以用排空法,因为乙炔和空气的密度很接近。烧瓶中不可以有水,否则和电石反应了。所用电石质量不能太大,产生乙炔太多超过B的容积,无法测定。也不能太小,否则 生成乙炔太少,测出体积数据小,误差大。由分液漏斗往烧瓶里滴加水的操作方法是轻轻旋开活塞,使水缓慢滴下,直到不再产生气体为止。量筒中水的体积就是乙炔的体积,可以算出电石中的碳化钙的质量,再算出其质量分数。
