(共12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。实验室可以用装置F制备氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
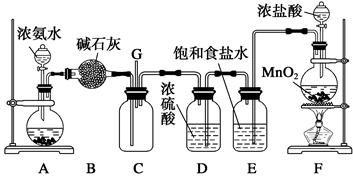
请回答下列问题:
(1)、装置F中发生反应的离子方程式为_______________________________________;
(2)、为了快速制备氨气,装置A的烧瓶中可装试剂_____________________;
(3)、B装置的名称是_____________;(填符号) A.洗气瓶 B.干燥管 C.分液漏斗
E装置的作用是__________________________________________________________;
(4)通入C装置的两根导管左边较长、右边较短,目的是________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:_________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。
(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
(2).CaO或.NaOH(1分)
(3) B,(1分) 除去氯气中的氯化氢(2分)
(4)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(5)3Cl2+8NH3===N2+6NH4Cl(2分)
(6)在G连接导管直接通入盛有烧碱的烧杯中(2分)
(1)F是来制取氯气的,方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)氨水具有挥发性浓度越大越易挥发,且气体的溶解度随温度的升高而降低,所以可以将氨水滴入生石灰或氢氧化钠固体中。
(3)根据B装置特点可判断,该仪器是干燥管。制取的氯气中含有氯化氢气体,所以需要利用饱和石灰水来除去杂质氯化氢。
(4)氨气的密度小于空气的,氯气的密度大于空气的,所以这样做的目的是为了使气体充分混合。
(5)氯气具有强氧化性,能氧化氨气,根据实验现象可判断生成物是氮气和氯化铵,方程式为3Cl2+8NH3===N2+6NH4Cl。
(6)氯气有毒,需要尾气处理。可以利用碱液来吸收多余的氯气。
