A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出下列元素符号:
A______ B______ C______ D______ E______.
(2)A与E两元素可形成化合物,写出电子式______
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)______.
由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E 中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和
“C元素的最外层电子数比次外层电子数少4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多3”,所以D为P,所以只能B为Al,A为Na.E可能为Cl或S,当E为S时,不满足“A、B、E 3种原子最外层共有11个电子”,所以E只能为Cl.
(1)由以上推断出元素,故答案为:Na、Al、Si、P、Cl;
(2)A与E两元素可形成化合物NaCl,故电子式为:
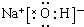
故答案为:
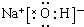
(3)A、B两元素最高价氧化物的水化物分别为:Na0H、Al(OH)3,因氢氧化铝具有两性,故反应的方程式为:Na0H+Al(OH)3═NaAl02+2H2O,
故答案为:Na0H+Al(OH)3═NaAl02+2H2O;
(4)C、D的最高价氧化物的水化物为:H2SiO3、H3PO4,根据元素周期律,因Si的非金属性小于P,所以酸性H2SiO3<H3PO4,故答案为:H2SiO3<H3PO4.
