(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol•L—1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol•L—1 | 0.016 | 0.016 | 0.0080 |
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
(I)负极:Cu —2e—= Cu2+ 正极:2Ag++2e—=2Ag
(II)(1)HCO3—+ H2O H2CO3 + OH—
H2CO3 + OH—
(2)c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)
(III)(1) 20% (2)A(g)+B(g)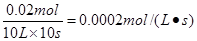 2C(g) 0.25 (3) 0.00020mol•L—1•s—1
2C(g) 0.25 (3) 0.00020mol•L—1•s—1
(1)在原电池中较活泼的金属作负极,失去电子发生氧化反应,正极得到电子,发生还原反应。根据反应可知铜失去电子,Ag+得到电子,所以正负极的电极反应式为2Ag++2e—=2Ag、Cu —2e—= Cu2+。
(2)由于碳酸氢钠在溶液中既有电离平衡,还有水解平衡。电离显酸性,水解显碱性。因为水解程度大于电离程度,所以溶液显碱性。因为在溶液中水还可以电离出氢离子,因此溶液中各离子的浓度由大到小的关系是c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)。
(3)根据数据可知消耗A的浓度是0.020mol/L-0.016mol/L=0.004mol/L,所以A的转化率是 ;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)
;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)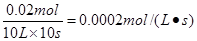 2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为
2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为 ;设A的转化量是x,则
;设A的转化量是x,则
A(g)+B(g)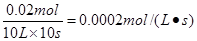 2C(g)
2C(g)
起始量(mol) 0.10 0.10 0
转化量(mol) x x 2x
平衡量(mol) 0.10-x 0.10-x 2x
根据平衡常数的表达式可知
解得x=0.02。所以用A表示的化学反应速率为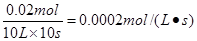 。
。
