(12分)NaClO2用于棉、麻、粘胶纤维及织物的漂白。实验室制备NaClO2的装置如下图所示:

(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是 。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是 ,检验该离子的方法是
(3)已知在NaClO2饱和溶液中温度低于38℃时析出晶体是NaClO2·3H2O,温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ;③ ;④ ;得到成品。
(4)装置Ⅲ中试剂X为 。
(1)将ClO2吹入到装置Ⅱ进行反应(2分)
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2(2分)
SO42-(1分) 取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-(2分)
(3)②趁热过滤(1分)③用38℃~60'℃热水洗涤(1分)④低于60'℃干燥(1分)
(4)NaOH溶液(合理答案均可)(2分)
(1)因为装置I中生成ClO2,为了提高原料的利用率,需要利用空气将生成的ClO2吹入到装置Ⅱ进行反应。
(2)ClO2既有氧化性,可将双氧水氧化成氧气,而自身被还原生成NaClO2,方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。由于进入装置Ⅱ的气体会混有二氧化硫气体,二氧化硫被氧化生成硫酸。检验SO42-一般用盐酸酸化的加BaCl2溶液。
(3)根据所给信息可知,要想得到NaClO2晶体,关键是控制温度。温度太高或太低均会产生杂质。
(4)由于在反应中会产生ClO2、SO2等大气污染物,所以需要尾气处理。

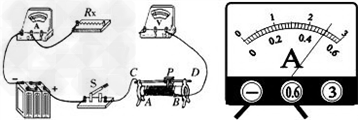
 )一个、电流表和电压表各一只、电键一个、导线若干.请你利用以上器材,为她设计一个实验电路图.
)一个、电流表和电压表各一只、电键一个、导线若干.请你利用以上器材,为她设计一个实验电路图.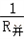 =
=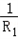 +
+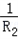 .小华还发现:并联总电阻比各支路电阻都要小;你通过分析还能发现_________.
.小华还发现:并联总电阻比各支路电阻都要小;你通过分析还能发现_________.