(15分)甲、乙两同学分别都用到铜与硫酸完成下列相关实验,请回答相应的问题.
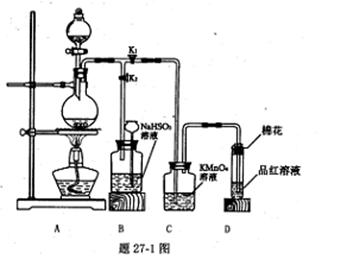
(1)甲同学用题27-1图所示装置实现铜跟浓硫酸反应制取少量硫酸铜溶液,并验证相关物质的性质.
①装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是_____.
②从C、D装置中观察到的现象,说明上述反应的某种生成物所具有的化学性质是 、__ __.
③装置B将用来储存多余气体,当D处有明显的现象后,关闭旋塞K.,打开K2移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_ .
(2)乙同学认为:铜虽不能与稀硫酸直接反应生成硫酸铜,但可以在稀硫酸与铜粉的混合物中分多次加入适量浓硝酸而得到不含NO3—的硫酸铜溶液.其装置如题27-2图所示.
①把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是____
②已知NO不能被NaOH溶液直接吸收:但已知有如下两个反应:
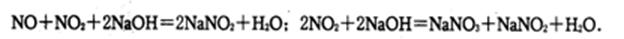
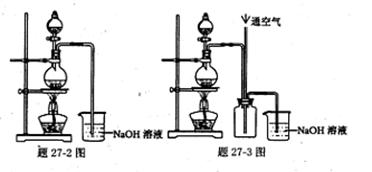
题27-3图是题27-2图的改进装置,其优点除可以防止倒吸外还有___ _
③将反应所得硫酸铜溶液经___ _、 、过滤、洗涤、干燥即可得到胆矾晶体.
④如果用1mol Cu来制取lmol CuSO4,则所需浓硝酸中HNO3的质量为 _,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液吸收并生成NaNO2,需通入空气的体积为____.(假设气体体积为标准状况下测定,空气中氧气占总体积的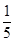 ,保留小数点后一位,并忽略装置中原有空气的影响)
,保留小数点后一位,并忽略装置中原有空气的影响)
(1)①吸收多余的二氧化硫,防止污染空气(2分)
②还原性、漂白性(2分)
③试剂瓶中液面下降,而长颈漏斗中液面上升(2分)
(2)①确保所有的硝酸都作氧化剂,在溶液中将铜氧化,只生成硫酸铜(2分)
②有害气体能被完全吸收(1分)
③蒸发浓缩、冷却结晶(2分)
④42g (2分) 18.7L(2分)
(1)①SO2是大气污染物,需要进行尾气处理,可用氢氧化钠吸收多余的SO2,防止污染空气。
②SO2具有还原性,能被酸性高锰酸钾溶液氧化,而使其褪色。同时SO2还具有漂白性,能使品红溶液褪色。
③由于SO2在饱和亚硫酸氢钠中溶解度很小,所以试剂瓶中压强会逐渐增大,因此试剂瓶中液面下降,而长颈漏斗中液面上升。
(2)①如果硝酸过量,则会生成硝酸铜。所以分次加入能确保所有的硝酸都作氧化剂,在溶液中将铜氧化,只生成硫酸铜。
②由于NO不能钡吸收,但在氧气的作用下能钡氧化生成NO2,从而确保有害气体能被完全吸收。
③要得到硫酸铜晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤和干燥等过程。
④1mol铜失去2mol电子,所以根据电子得失守恒可知,需要硝酸的物质的量是2/3mol,其质量是2/3mol×63g/mol=42g。生成NO是2/3mol,而氧化产物是亚硝酸钠,所以反应中转移电子是2/3mol。设空气的体积为VL,则根据电子得失守恒可知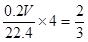 ,解得V=18.7L。
,解得V=18.7L。
