(22分)某中学化学兴趣小组想制取饱和氯水,并进行氯水的性质实验。他们使用如图装置制取较多量的饱和氯水,请回答:
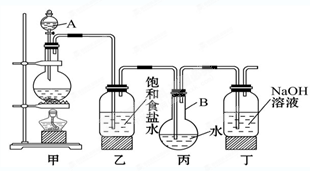
(1)写出仪器的名称:A_________, B _________ 。
(2)写出丙、丁装置中发生反应的离子方程式:
丙_________________________________________________。
丁_________________________________________________。
(3)有同学提出如下改进建议:
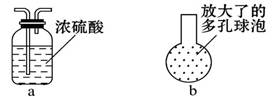
①在乙和丙之间增加上图中的a装置,你认为有无必要_______ (填“有”或“无”)。
②在丙的长导管下口处,接上图中的b装置,可以提高氯气的吸收效果。原因是_______________________________ ____。
(4)用制得的氯水分别进行下列实验:①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是_____;
②滴入AgNO3溶液中,发生反应的离子方程式____________________________________。
(5)用滴管将制得的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然褪去。产生上述现象的原因可能有两种(简要文字说明):
①是由于__________________________________________;
②是由于__________________________________________。
用实验证明红色褪去的原因是①或者②的实验方法是__ ___
。
(6)为了提高氯水中次氯酸的浓度,增强氯水的漂白能力,可向氯水中加入的试剂_____(填序号)。
A.CaCO3
B.Na2SO3
C.H2SO4
D.Ca(OH)2
(1)分液漏斗 圆底烧瓶
(2)Cl2+H2O H++Cl-+HClO Cl2+2OH-=Cl-+ClO-+H2O
H++Cl-+HClO Cl2+2OH-=Cl-+ClO-+H2O
(3)①无 ②可增大Cl2与水的接触面积 (4) ①H+ ②Ag++Cl- ====AgCl↓
(5) 盐酸中和了氢氧化钠 次氯酸将酚酞氧化了 向褪色后的溶液里再滴加氢氧化钠溶液,若溶液变红,说明是原因①,若溶液不变红说明是原因② (6) A
(1)根据仪器的结构特点可知,AB分别是分液漏斗、圆底烧瓶。
(2)氯气能和水反应生成氯化氢和次氯酸,所以方程式为Cl2+H2O H++Cl-+HClO、Cl2+2OH-=Cl-+ClO-+H2O。
H++Cl-+HClO、Cl2+2OH-=Cl-+ClO-+H2O。
(3)①a装置的目的是干燥氯气,但氯气和氢氧化钠反应是没有必要干燥的。
②根据装置的结构可知,通过b装置可增大Cl2与水的接触面积,从而提高吸收效率。
(4)①能和碳酸钠反应产生气体的应该是H+。
②Cl-能和硝酸银发生产生氯化银沉淀,方程式为Ag++Cl- ====AgCl↓。
(5)①由于碱液能是酚酞试液显红色,所以能使酚酞试液褪色的原因是盐酸中和了氢氧化钠,碱性降低引起的。又因为次氯酸碱液强氧化性,能把酚酞试液氧化而褪色。
②验证的方法是继续滴加氢氧化钠溶液,即向褪色后的溶液里再滴加氢氧化钠溶液,若溶液变红,说明是原因①,若溶液不变红说明是原因②。
(6)次氯酸能和亚硫酸钠以及氢氧化钙反应,所以选项BD不正确。硫酸是强酸,能抑制氯气和水的反应,C不正确。碳酸钙能和盐酸反应,但和次氯酸不反应,所以选项A正确。
