(16分)某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
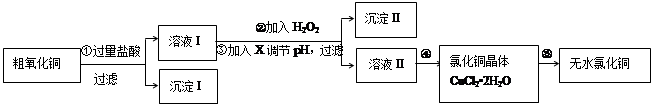
(1)步骤①中涉及的离子方程式有: 。
(2)步骤②中加入H2O2的目的是: 反应的离子方程式为 。
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
步骤③中可以用于调节溶液pH的试剂X是 :
a.Cu2(OH)2CO3 b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤④进行的操作是 ,过滤、洗涤、干燥。 在步骤⑤中要得到无水CuCl2,需要在 加热CuCl2·2H2O。
(16分)(1)CuO+2H+=Cu2++H2O(2分),FeO+2H+=Fe2++H2O(2分);
(2)将Fe2+氧化成Fe3+(2分), 2Fe2++H2O2+2H+=2Fe3++2H2O(2分);
(3)3.2至4.7(2分); a b c (2分);
(4)蒸发浓缩,冷却结晶(2分)。干燥的HCl气流中(2分)
】(1)氧化铜是碱性氧化物,和盐酸反应的离子方程式为CuO+2H+=Cu2++H2O。
(2)由于溶液中含有亚铁离子,而亚铁离子的沉淀pH大于铜离子的,所以应该把亚铁离子转化为铁离子而产生氢氧化铁沉淀,从而除去杂质。
(3)要沉淀铁离子而保留铜离子,则根据pH可知,应该是3.2至4.7之间。由于调节pH是不能引入杂质的,所以答案选bc。
(4)要得到氯化铜晶体,则应该是蒸发浓缩,冷却结晶,然后过滤、洗涤干燥即可。氯化铜是强酸弱碱盐,水解生成氢氧化铜和氯化氢。所以在加热过程中,应该在氯化物的气流中进行以防止CuCl2发生水解。
