问题
填空题
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在B单质中燃烧时呈现黄色火焰,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______ C______
(2)写出AB2 的电子式为______
(3)画出D的原子结构示意图______,用电子式表示化合物 C2D 的形成过程______.
答案
A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;D单质颜色是淡黄色固态化合物,则D为硫元素;A和B原子有相同的电子层数,且C在B单质中燃烧时呈现黄色火焰,则B为氧元素,C为钠元素,生成化合物为过氧化钠.
(1)由上述分析可知,A为碳元素;C为钠元素.
故答案为:碳;钠.
(2)AB2 是CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为
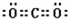
.
故答案为:
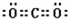
.
(3)D为硫元素,原子核外有16个电子,有3个电子层,最外层有6个电子,的原子结构示意图为
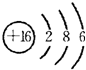
. C2D 为Na2S,由钠离子与硫离子构成,电子式表示Na2S的形成过程为

.
故答案为:

;

.
