(12分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是

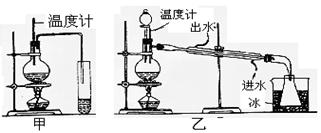
(1)图甲和乙是两套实验室制乙醚的装置,选装置 最合适,理由是 __ 。
(2)反应液中应加入沸石,其作用是 。
(3)反应中温度计水银球的位置是 __________________ 。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是 ,除去这种杂质的简易方法是 。
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
,反应类型是 。
(1)乙(1分);冷却效果好,乙醚远离火源(2分)。(2)防止暴沸。(1分)(3)插入反应物液面以下,但不能触及瓶底。(2分)(4)乙醇(1分);将其与饱和Na2CO3溶液混合,后静置分液。(2分)
(5) CH3CH2OH CH2=CH2↑+H2O(2分) 消去(1分);
CH2=CH2↑+H2O(2分) 消去(1分);
(1)乙装置有冷凝管,冷却效果好。因为乙醚极易挥发、易燃烧,而乙装置中收集乙醚的锥形瓶离酒精灯较远,比较安全。
(2)反应需要加热,为防止液体受热时剧烈跳动,需要用碎瓷片以防暴沸。
(3)生成乙醚的温度是140℃,温度如果超过140℃,就有可能生成乙烯,所以必须可知溶液的温度。因此温度计的水银球要插入反应物液面以下,但不能触及瓶底。
(4)由于乙醇也易挥发,所以生成的乙醚中会混入乙醇。乙醇和水互溶,乙醚在饱和Na2CO3溶液中几乎不溶,所以可通过饱和碳酸钠溶液来除去乙醇。
(5)在170℃时乙醇会发生消去反应生成乙烯,方程式为
CH3CH2OH CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
