U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体.
请回答下列问题:
(1)Z元素在周期表中的位置______.W、X、Y、Z四种元素的原子半径由小到大的顺序是______(用元素符号表示).
(2)U与X形成的18电子化合物的电子式是______.
(3)ZX2与NaOH溶液反应的化学方程式是______.
(4)你认为U、W、X元素形成的化合物之间______(填“能”或“不能”)发生如下反应:WX+WU3→UWX2+U2X,得出此结论的理由是______.
(5)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共a L(标准状况),则Y单质的质量是______g(用含a的代数式表示).
U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,则U为H,W为N,A为
NH3,U与X可形成常温下呈液态的分子B,A、B均为10电子分子,则X为O,B为H2O;Y元素原子的K层电子数与M层电子数相同,则Y为Mg;Z元素的单质、氧化物均为原子晶体,则Z为Si,
(1)Si的质子数为14,位于第三周期ⅣA族,原子的电子层数越多,半径越大,同周期元素从左向右原子半径在减小,则原子半径为O<N<Si<Mg,
故答案为:第三周期ⅣA族;O<N<Si<Mg;
(2)U与X形成的18电子化合物为H2O2,其电子式为
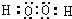
,故答案为:
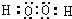
;
(3)SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(4)NO+NH3→HNO2+H2O中,只存在N元素的化合价升高,而不存在化合价降低的元素,即此反应关系中,只有失电子的物质,没有得电子的物质,则该反应不能发生,
故答案为:不能;在此反应关系中,只有失电子的物质,没有得电子的物质;
(5)Mg与二氧化碳的反应为2Mg+CO2
2MgO+C,C与浓硝酸反应生成二氧化碳和二氧化氮,设二氧化碳的物质的量x, 点燃 .
由电子守恒可知,x×4=(
-x)×1,解得x=aL 22.4L/mol
mol,a 22.4×5
再由2Mg+CO2
2MgO+C可知,Mg的物质的量为 点燃 .
mol×2=a 22.4×5
mol,2a 22.4×5
则Mg的质量为
mol×24g/mol=2a 22.4×5
=2×24a 22.4×5
,故答案为:3a 7
或2×24a 22.4×5
.3a 7
