(17分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为 ;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是
① ,② (填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下) Cl2完全反应,则反应过程中转移电子的物质的量为 。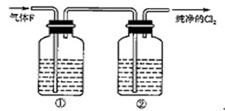
(17分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(3分)
Mn2++Cl2↑+2H2O(3分)
(2)①氯化氢挥发②反应生成水③反应消耗HCl(共5分)
(3)饱和食盐水或水、浓硫酸(每空3分,共6分) (4)0.01mol(3分)
(1)实验室制取氯气的方程式为)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)由于浓盐酸异挥发,生成物有水生成,同时氯化氢不断被消耗,都使盐酸的浓度降低。
(3)制取的氯气含有的杂质气体是氯化氢和水蒸气。所以首先通过饱和食盐水除去氯化物,最后通过浓硫酸干燥即可。
(4)氯气和强碱的反应中,氯气既是氧化剂,又是还原剂。氯气的还原产物是氯离子,所以消耗1mol氯气,反应中就转移1mol电子。标准状况下224ml气体是0.01mol,则转移电子是0.01mol。
