(共7分)某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
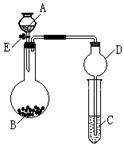
(1)若A为浓氨水,B为氧化钙,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为 ,圆底烧瓶中发生反应的化学方程式为 ;
(2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为 ,圆底烧瓶中发生反应的化学方程式为 ;
(3)利用上述装置还可以验证SO2的化学性质, A为较浓硫酸,B为亚硫酸钠,则C中盛有
溶液可验证SO2的氧化性; C中盛有 溶液可验证其还原性; 而C中盛有 溶液可验证其漂白性。
1)有白色沉淀生成,CaO+NH3·H2O==Ca(OH)2+ NH3↑
(2)颜色由浅绿色变为棕黄色 2H2O2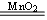 2H2O+ O2↑
2H2O+ O2↑
(3)H2S 氯水或溴水或酸性高锰酸钾 品红
(1)浓氨水滴入生石灰中生成氨气,发生的反应是CaO+NH3·H2O==Ca(OH)2+ NH3↑。氨气和氯化铝反应生成氢氧化铝白色沉淀。
(2)双氧水在二氧化锰的催化作用下,生成氧气,方程式为2H2O2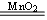 2H2O+ O2↑。氧气能把亚铁离子氧化生成铁离子,即溶液颜色由浅绿色变为棕黄色。
2H2O+ O2↑。氧气能把亚铁离子氧化生成铁离子,即溶液颜色由浅绿色变为棕黄色。
(3)SO2能把硫化氢氧化生成单质硫,也能还原溴水或氯水或酸性高锰酸钾溶液。SO2也具有漂白性,能使品红溶液褪色。