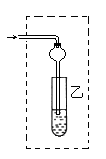
(10分)在实验室中学生用下左图装置制取乙酸乙酯。

写出该反应的化学方程式______________________________。
回答下列问题:
(1)在大试管中加入浓硫酸3mL、冰醋酸3mL(3 g)、乙醇4mL(2.7 g),加入试剂的正确操作是__________________________________。
(2)装置中通蒸汽的导管只能插到饱和碳酸钠溶液的液面上方,不插入溶液中,作用是__________,长导管的作用是_______________。试设计另一个装置也能实现上述两个作用,在虚线部分画出该装置简图。
(3)试管乙中的现象是_______ ,由此可知乙酸乙酯的物理性质有_________________ 。
(4)充分反应后,制得乙酸乙酯的质量_______________g。
(5)工业用石油裂解气的主要成分为原料制取乙酸乙酯,经过的反应类型(按反应顺序)是_________________________。
CH3COOH+CH3CH2OH 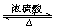 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)在试管中加4mL乙醇,然后边摇动试管边慢慢加入3mL浓硫酸和3mL 乙酸。(只要后加浓硫酸;边摇动试管边慢慢加试剂均可)
(2)防止倒吸 导气、冷凝
(3)饱和碳酸钠溶液的液面上有透明的油状液体产生,可闻到香味。
乙酸乙酯不溶于水;密度比水小;易挥发(或沸点低)。
(4)小于4.4g
(5)加成反应、氧化反应、酯化反应
实验室制取乙酸乙酯用乙酸和乙醇作用,方程式为CH3COOH+CH3CH2OH 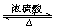 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)浓硫酸溶于水放出大量的热,且密度大于水的,所以应该是在试管中加4mL乙醇,然后边摇动试管边慢慢加入3mL浓硫酸和3mL 乙酸。
(2)挥发出来的乙酸和乙醇都是和水互溶的,如果直接插入溶液中,易倒吸。长导管能起导气和冷凝作用。要起以上的作用,可用竖直的干燥管即可,如图所示(见答案)。
(3)乙酸乙酯不溶于水,所以在饱和碳酸钠溶液的液面上有透明的油状液体产生,且可闻到香味。
(4)根据所给数据开始,理论上生成乙酸乙酯应该是3g+2.3g-0.9g=4.4g,但反应但可逆反应,所以实际生成的乙酸乙酯小于4.4g。
(5)裂解气中含有乙烯,乙烯和水加成即得到乙醇,乙醇氧化即得到乙酸,乙酸和乙醇酯化即生成乙酸乙酯。
