(10分)下图为某实验小组的同学制备乙烯及验证乙烯性质的部分装置图,请回答:

(1)烧瓶中加入的两种试剂是__________________________;
(2)温度计的作用是____________________,碎瓷片的作用是_________________________;
(3)写出实验中产生乙烯的化学方程式:_____ __;
(4)甲同学认为:溴水褪色的现象不能证明乙烯具有不饱和性,其原因是烧瓶中液体呈棕黑色而产生_____________气体。乙同学经过仔细观察后认为:试管中另一个现象可证明乙烯具有不饱和性,这个现象是 ________________。丙同学为验证这一反应是加成而不是取代,提出了将杂质气体吸收后,可用pH试纸来测试反应后溶液的酸性,理由是____________________________________;
(5)处理上述实验中烧瓶内废液的正确操作是_______________。
A.废液直接倒入下水道
B.废液倒入空废液缸中
C.将水倒入烧瓶中
D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道
(1)乙醇,浓硫酸;(2)控制反应温度在170℃,防止暴沸;
(3)CH3CH2OH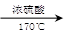 CH2==CH2↑+H2O
CH2==CH2↑+H2O
(4)SO2;有不溶于水的油状物生成;如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。 (5)D
(1)实验室制取乙烯是利用乙醇在浓硫酸的作用下发生消去反应产生的。
(2)乙醇发生消去反应生成乙烯的反应中,温度必须控制在170℃,所以温度计的作用是控制反应温度在170℃。为了防止液体受热时剧烈跳到,需要加入碎瓷片防止暴沸。
(3)方程式为CH3CH2OH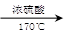 CH2==CH2↑+H2O
CH2==CH2↑+H2O
(4)由于浓硫酸具有脱水性和强氧化性,因此在反应中浓硫酸可以把乙醇氧化,而硫酸则被还原生成SO2气体,SO2具有还原性,能使溴水褪色。乙烯能使溴水褪色,产生不溶于水的油状物生成,即证明乙烯具有不饱和性,能和溴水发生加成反应。如果发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性。即溶液酸性将会明显增强,故可用pH试纸验证。
(5)废液中含有浓硫酸,所以选项D是正确的,答案选D。
