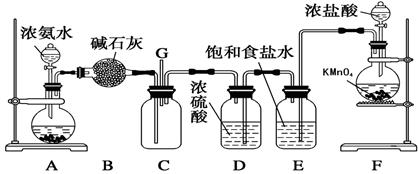
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________。(提示,高锰酸钾的还原产物为Mn2+)
(2) B装置的名称是__________;A装置中的固体可能是________。
(3)通入C装置的两根导管左边较长、右边较短,目的是__________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________
(1)2MnO4- + 10 Cl- + 16H+ = Mn2+ + 5Cl2↑ + 8H2O (2分)
(2) 干燥管(1分) 碱石灰或生石灰等 (1分)
(3) 使密度大的氯气与密度小的氨气较快地均匀混合 (2分)
(4) 3Cl2+8NH3===N2+6NH4Cl (2分)
(1)F装置是制取氯气的,所以根据还原产物可知,反应的方程式是2MnO4- + 10 Cl- + 16H+ = Mn2+ + 5Cl2↑ + 8H2O。
(2)根据装置B的构造可知,B是干燥管;A装置是制取氨气的,由于氨水中存在平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,因此要得到氨气,则平衡必需向逆反应方向进行,所以A中的固体可以是碱石灰或生石灰。
NH4++OH-,因此要得到氨气,则平衡必需向逆反应方向进行,所以A中的固体可以是碱石灰或生石灰。
(3)由于氨气的密度小于空气的,而氯气的密度大于空气的,所以密度是使密度大的氯气与密度小的氨气较快地均匀混合。
(4)根据现象可知,白烟是氯化铵,根据原子守恒可知,另一种气体应该是氮气,所以方程式是3Cl2+8NH3===N2+6NH4Cl。
