(16分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。
当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
(1)MnO2+4H++2Cl-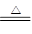 Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)生石灰或固体氢氧化钠或碱石灰(2分)
(3)干燥管(2分) 除去氯气中的氯化氢(2分)
(4)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(5)3C12+8NH3=N2+6NH4Cl(2分) b/2a mol-1(2分)
(6)在G连接导管直接通人盛有烧碱的烧杯中(2分)
(1)F是制取氯气的,方程式为MnO2+4H++2Cl-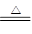 Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置A是制取氨气的,由于氨水中存在平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,所以要生成氨气,应该使平衡向逆反应方向移动,因此可以是生石灰或固体氢氧化钠或碱石灰等。
NH4++OH-,所以要生成氨气,应该使平衡向逆反应方向移动,因此可以是生石灰或固体氢氧化钠或碱石灰等。
(3)根据装置的结构可知B是干燥管。浓盐酸易挥发,生成生成的氯气中含有氯化氢气体,因此饱和食盐水的作用是除去氯气中的氯化氢。
(4)氯气的密度大于空气的,氨气的密度小于空气的,所以C装置的两根导管左边较长、右边较短的目的就是使密度大的氯气与密度小的氨气较快地均匀混合。
(5)C内出现浓厚的白烟并在容器内壁凝结,说明有氯化铵生成。另一生成物是空气的主要成分之一,则是氮气,所以方程式为3C12+8NH3=N2+6NH4Cl。根据方程式可知a mol氯气反应转移2amol电子,所以伏加德罗数常数为 b/2a mol-1。
(6)氯气有毒,需要尾气处理装置,所以方法是在G连接导管直接通人盛有烧碱的烧杯中。
