(10分)某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸 mL(准确到小数点后一位)。
(2)配制该稀硫酸时使用的仪器除量筒、烧杯、200mL容量瓶外,还必须用到的仪器有 、 等。
(3)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是( )
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上
D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响(4)在配制过程中,下列因素对所配制的稀硫酸的物质的量浓度有何影响?
若容量瓶未干燥即用来配制溶液,则所得溶液浓度 0.9 mol·L-1(填“大于”、“等于”或“小于”,下同);若定容时俯视刻度线,则所得溶液浓度 0.9 mol·L-1。
(共10分) (1)10.0 (2分)
(2)玻璃棒 胶头滴管(可颠倒)。(每空1分)
(3)B(2分) (4)等于 大于(每空2分)
题目分析:(1)在浓硫酸的稀释过程中,溶质是不变的,所以需要量取浓硫酸的体积是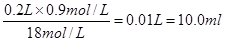 。
。
(2)稀释浓硫酸、向容量瓶中转移硫酸时都需要玻璃棒。另外定容时还需要胶头滴管。
(3)根据容量瓶的结构可知,瓶颈越粗,精确度越低,所以该建议不可取,答案选B。
(4)根据n=c·V可知,如果容量瓶没有干燥,则溶质的溶液的体积不受影响,浓度不变;如果定容时俯视刻度线,则所得溶液的体积偏少,浓度偏高。
点评:该题是高考中的常见题型,属于中等难度的试题。试题侧重考查学生的基础知识,兼顾能力的考查。该题的难度在于误差分析,配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
