(13分)甲乙两位同学分别用不同的方法配制100 mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要用到浓硫酸的体积为__________。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是________________________________。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__________________。
③定容的正确操作是___________________________________________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度线,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制(3)乙学生:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100 mL刻度线,搅拌均匀,你认为此法是否正确?若正确,不用解释原因;若不正确,指出其中错误之处______________________ _ ______
_______________ ________。
(1)20.0 mL
(2)①将玻璃棒插入容量瓶刻度线以下,轻靠瓶壁,把溶液沿玻璃棒慢慢地倒入容量瓶中
②使溶质完全转移到容量瓶中
③加水至离刻度线1-2cm时,改用胶头滴管加水至凹液面与刻度线相切
④D (3)不正确。不能用量筒配制溶液,不能将水加入到浓硫酸中
(1)需要用到浓硫酸的体积为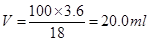 。
。
(2)①将溶液转移到容量瓶中相应玻璃棒的引流,即玻璃棒插入容量瓶刻度线以下,轻靠瓶壁,把溶液沿玻璃棒慢慢地倒入容量瓶中。
②洗涤液中含有溶质硫酸,因此目的是使溶质完全转移到容量瓶中。
③定容是相应胶头滴管,即加水至离刻度线1-2cm时,改用胶头滴管加水至凹液面与刻度线相切。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度线,这说明实验失败,相应重新配制。答案选D。
(3)量筒是用来量取液体的,不能用来稀释。浓硫酸溶于水放热,且浓硫酸的密度大于水的,所以稀释浓硫酸应该把浓硫酸沿着器壁注入水中。