(12分)今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
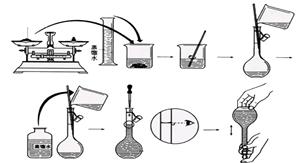
请根据题意回答:
(1)配制该溶液应选用 (填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应 。
(4)配制好的溶液 (填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是
A.容量瓶中原来有少量蒸馏水
B.定容时观察液面俯视
C.忘记洗涤
D.定容时观察液面仰视
(1)100 mL容量瓶(只答 容量瓶给一分)
(2)小烧杯、2g(只填数据0分)
(3)重做 (4)不能 (5)CD(少一个得1分,错一个得0分)
考查一定物质的量浓度溶液的配制。
(1)准确配制100mL 0.5mol/L的NaOH溶液,应该选择100ml容量瓶。
(2)100mL 0.5mol/L的NaOH溶液中含有氢氧化钠是0.1L×0.5mol/L=0.05mol,质量是m=0.05mol×40g/mol=2.0g。又因为氢氧化钠具有吸水性和腐蚀性,因此称量时应该放在小烧杯中。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,则只能是重新配制。
(4)容量瓶不能长时间盛放溶液,因此配制完之后,必须及时转移到相应的试剂瓶中。
(5)根据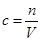 可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。
可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。


