(12分) 下图是实验室中制备气体或验证气体性质的装置图
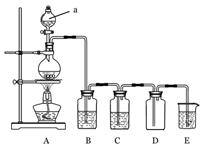
(1)仪器a的名称是_______________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________。
②装置B中的溶液为____________________;烧杯中溶液的作用为________________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为__________。
②D中应加入足量的____________(填溶液名称),E中加入____________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为____________________________。
(1)分液漏斗 (2)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
②饱和食盐水 吸收多余的氯气,防止污染空气
(3)①B中品红溶液褪色
②酸性高锰酸钾溶液,硅酸钠溶液,D中高锰酸钾溶液不褪色,E中溶液变浑浊
(1)根据a的结构可判断,a是分液漏斗。
(2)①实验室制取氯气的试剂是二氧化锰和浓盐酸,方程式为
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②由于浓盐酸易挥发,因此生成的氯气中含有氯化氢杂质,所以B中可以盛放饱和食盐水来除去氯化氢;由于氯气有毒,直接排放会污染空气,所以烧杯中应该盛放氢氧化钠溶液,原来吸收多余的氯气,防止污染空气。
(3)①碳在加热的条件下,能被浓硫酸氧化,生成SO2和CO2以及水。所以如果B中品红溶液褪色,则就能证明SO2具有漂白性。
②要证明碳元素的非金属性比硅元素的强,则可以利用较强的酸制取较弱的酸来实现,即将生成的CO2通入到硅酸钠溶液即可。但由于SO2也能和硅酸钠反应,所以要先除去SO2,可以利用SO2的还原性,通过酸性高锰酸钾溶液除SO2。所以D中加入的是酸性高锰酸钾溶液,用来检验SO2是否被除尽。E中加入的则是硅酸钠溶液,因此当D中高锰酸钾溶液不褪色,E中溶液变浑浊时,即能证明碳元素的非金属性比硅元素的强。
