某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②_____________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式____________。
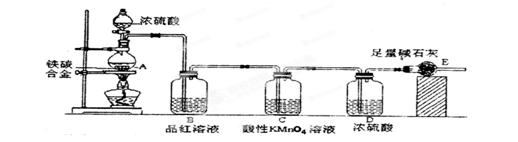
(3)B中的现象是:____________;C的作用是:_______________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为_____________。
(1)常温下Fe遇浓硫酸发生钝化。
(2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)品红溶液褪色 除尽反应产物中的SO2气体
(4)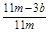
题目分析:(1)铁碳合金加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,原因是①碳在未加热下与浓硫酸不反应;②围绕常温下Fe遇浓硫酸发生钝化即可解答。
(2)加热时A中碳与浓硫酸发生反应的化学方程式是C+2H2SO4(浓)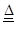 CO2↑+2SO2↑+2H2O,注意反应的条件,气体标箭头。
CO2↑+2SO2↑+2H2O,注意反应的条件,气体标箭头。
(3)A中反应生成SO2能使品红溶液褪色,混合气体中含有SO2和CO2,为了计算出CO2,应先除去SO2,所以C用来除去SO2。
(4)根据CO2+Ca(OH)2=CaCO3↓+H2O,E增重b g,可算出碳的质量有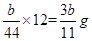 g,则铁的质量分数:
g,则铁的质量分数:
点评:这是一道考查铁碳合金与浓硫酸反应的综合实验题,注意积累相关知识点即可解答。
