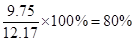溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:
步骤1:在a中(装置如右下图所示)加入15mL无水的苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10mL水8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品。
| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是 。
(3)仪器c的作用是冷凝回流,回流的主要物质有 。(填化学式)
(4)步骤3中第一次用10mL水洗涤的主要操作步骤为 。
(5)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如左上表,则要进一步提纯粗产品,还必须进行的实验操作名称是 。
(6)若步骤4的粗产品经进一步精制得到6.5mL的溴苯。则该实验中溴苯的产率是 。
(1)三颈烧瓶(2)防止反应放出的热使C6H6、Br2挥发而影响产率
(3)C6H6、Br2
(4)将滤液置于分液漏斗中,加入10 mL水,充分振荡后静置分液(分离出上层物质待用)
(5)蒸馏(6)80%
(1)根据仪器的构造可知,应该是三颈烧瓶。
(2)由于反应是放热的,且苯和液溴都是易挥发的,所以目的是防止反应放出的热使C6H6、Br2挥发而影响产率。
(3)根据(2)的分析可知,回流的物质是C6H6、Br2。
(4)溴苯不溶于水,所以操作是将滤液置于分液漏斗中,加入10 mL水,充分振荡后静置分液(分离出上层物质待用)。
(5)苯、溴苯的沸点相差较大,通过蒸馏即可。
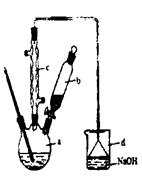
(6)苯的质量是15×0.88=13.2g,液溴是3.1×4=12.4g。所以根据方程式可知,苯是过量的,因此应该生成溴苯是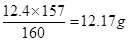 。实际生成溴苯是6.5×1.5=9.75g,所以产率是
。实际生成溴苯是6.5×1.5=9.75g,所以产率是