(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
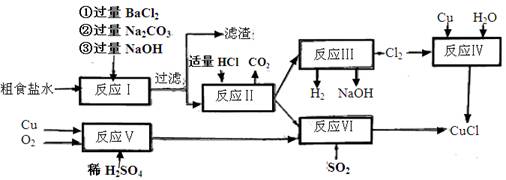
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是  。
。
(10分,每空2分)
(1)除去Ca2+和过量的Ba2+(2分)
(2)2Cl—2e-=Cl2↑(2分)
(3)①2Cu+O2+2H2SO4=2CuSO4+2H2O(3分)
②2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4(3分)
或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4
(4)H2SO4 NaOH (可以写名称各1分))(共2分)
(5)在防止生成CuCl2(2分)
(6)加快乙醇和水的蒸发,(1分)防止CuCl被空气氧化(1分) (共2分)
反应I是粗盐不的除杂过程,过滤后的滤液中加入适量盐酸(反应II),得到纯净的NaCl溶液;反应III是电解食盐水得到氯气,与铜、水一起制取CuCl。
反应V是制取硫酸铜,与SO2、NaCl通过反应VI也可制取CuCl
(1)在除杂过程中加Na2CO3溶液有两个作用:除去原溶液中的Ca2+及引入的Ba2+;
(2)电解食盐水:阳极:2Cl—2e-=Cl2↑;阴极:2H+ +2e-=H2↑;总反应式:2NaCl+2H2O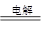 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)反应V中铜氧化为氧化铜,再与硫酸反应可得硫酸铜;
(4)由工艺流程可知,反应V消耗硫酸,而反应VI可产生硫酸;反应I消耗NaOH,而反应III电解食盐水过程中又可生产NaOH溶液。故在整个合成过程中可以循环利用的物质是硫酸和烧碱
(5)由于氯气氧化性强,与铜反应时时容易生成氯化铜
(6)结合题目所给信息,在真空机中可防止产品的氧化、70℃温度可加快乙醇和水的蒸发
