硝土中含有硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料来制取硝酸钾。其主要生产流程为:
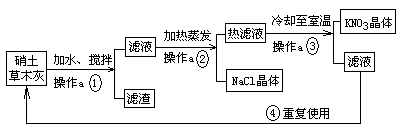
(1)操作a的名称 。
(2)写出步骤①中生成MgCO3沉淀的化学方程式:_______________________________。
(3)步骤④中滤液可重复使用的理由是 。
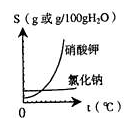
(4)参考右图,解释生产流程中用蒸发结晶得到NaCl晶体,而用
冷却结晶得到KNO3晶体的原因:_________________________
_____________________________________________________。 
(1)过滤 (2)Mg(NO3)2+ K2CO3==MgCO3↓+2KNO3
(3) 滤液中含有较多的KNO3(或重复利用滤液中的KNO3,节约原料,提高原料的利用率)
(4)NaCl的溶解度受温度变化的影响较小,KNO3的溶解度受温度变化的影响较大。
分析:(1)过滤是分离固液混合物的常用的操作方法,该操作后可得到滤液和固体滤渣;
(2)根据复分解反应发生的条件,硝土中的硝酸镁、硝酸钙可与草木炭的主要成分碳酸钾发生反应,生成碳酸镁或碳酸钙沉淀及硝酸钾;
(3)冷却至室温过程中,热的硝酸钾饱和溶液析出晶体时,仍有部分硝酸钾溶解在滤液中;可再次参与制取硝酸钾,进行硝酸钾的提取;
(4)根据溶解度曲线图,可确定两物质的溶解度受温度影响的不同,利用这个差异解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因.
解答:解:(1)根据操作a完成后得到滤液和固体物质滤渣,可判断操作a为过滤操作;
(2)硝土中的硝酸镁与草木灰主要成分碳酸钾反应,生成碳酸镁沉淀和硝酸钾,化学方程式为Mg(NO3)2+K2CO3═MgCO3↓+2KNO3;
(3)降温结晶析出晶体后的溶液仍为该溶质的饱和溶液,因此,滤液中还较有较多的硝酸钾,通过再次操作可继续获得硝酸钾晶体;
(4)根据溶解度曲线图,氯化钠的溶解度受温度影响不大,在获得氯化钠晶体时应采取蒸发结晶的方法,而硝酸钾的溶解度随温度改变变化较大,采取降温结晶获得硝酸钾晶体更为方便;
故答案为:
(1)过滤
(2)Mg(NO3)2+K2CO3═MgCO3↓+2KNO3
(3)滤液中含有较多的KNO3(或重复利用滤液中的KNO3,节约原料,提高原料的利用率)
(4)NaCl的溶解度受温度变化的影响较小,KNO3的溶解度受温度变化的影响较大.
