(8分)氯化钙是重要的化工原料。某工业碳酸钙所含的杂质主要是氧化铁及
一些不与酸碱反应的难溶性物质,以这种工业碳酸钙为原料生产氯化钙的主要流程如下图
所示:
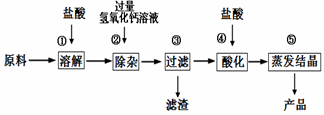
(1)用化学方程式表示由碳酸钙生成氯化钙的反应原理: 。
(2)步骤③得到的滤渣含有氢氧化铁,请写出步骤②发生复分解反应生成氢氧化铁的化学方程式: 。
(3)步骤④加入盐酸的目的是除去 ;步骤⑤利用盐酸的 性质,除去过量的盐酸。
(8分)(1)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑。
(2)3Ca(OH)2 + 2FeCl3 = 3CaCl2 + 2Fe(OH)3↓
(3)氢氧化钙[或Ca(OH)2];挥发。
:(1)碳酸钙可以和盐酸反应生成氯化钙,所以该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)在工业碳酸钙中含有氧化铁,所以加入盐酸后,氧化铁可以和盐酸反应生成了氯化铁,氯化铁和加入的氢氧化钙反应生成了氢氧化铁,故可以写出该反应的化学方程式:3Ca(OH)2 +2FeCl3 ═3CaCl2 +2Fe(OH)3↓;
(3)由于加入的氢氧化钙是过量的,所以在最后的滤液中含有氢氧化钙,如果直接蒸发则会使制得的氯化钙不纯,所以加入稀盐酸来中和氢氧化钙,而盐酸具有挥发性,所以加热时盐酸挥发出来,剩余的固体为氯化钙.
故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)3Ca(OH)2 +2FeCl3 ═3CaCl2 +2Fe(OH)3↓;
(3)氢氧化钙[或Ca(OH)2];挥发.
