(9分)某校学生利用下图所示装置验证氯气与氨气之间的反应(部分装置已略去)。其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
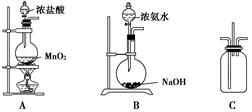
请回答下列问题:
(1)装置A中发生反应的离子方程式为___________________________________。
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是_____________________。
(3)装置C中氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,该反应的化学方程式为_____________________________________。
(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为___________.
(1)MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O(2分)
(2)NaOH具有吸水性并且溶于水时放出大量热,OH-浓度增大,有利于平衡向生成氨气的方向移动(3分)
(3)3Cl2+8NH3===6NH4Cl+N2(2分)
(4)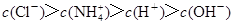 (2分)
(2分)
题目分析:本实验的目的是验证氯气与氨气之间的反应。
(1)装置A是制氯气的装置,二氧化锰与浓盐酸加热生成氯气的反应,注意浓盐酸拆开,方程式为MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O。
(2)用固体氢氧化钠的原因是氢氧化钠固体吸水放出热量;同时OH-浓度增大,有利于平衡向生成氨气的方向。用氧化钙也可以达到目的。
(3)有浓厚的白烟不是氯化氢,是氯化铵固体,常见的气体单质是氨气,化学方程式为3Cl2+8NH3===6NH4Cl+N2。
(4)氯化铵溶液中铵根离子要水解,氯离子浓度最大,离子浓度由大到小的顺序为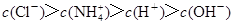 。
。
点评:根据现象写出方程式要注意能准确判断产物。属于简单题。

