(10分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
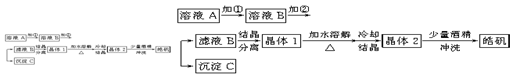
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7
Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(1)20%的H2O2(2分) 将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质(2分)
(2)bcd (2分) (3)重结晶 (2分)
(4)为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率(2分)
题目分析:
(1)本题需要把Fe3+转化为Fe2+,使用的试剂有氧化性,并且不能引入新的杂质,使用20%的H2O2是最佳的选择。
(2)能调节溶液pH值,而不引入新的杂质。
(3)重结晶的作用是使结晶更加纯净。
(4)不能用水,否则晶体会重新溶解。用酒精洗涤掉晶体表面的杂质离子。
点评:本题以工业制皓矾为背景,结合生产实际。试题过程解答不难,需要抓住题目的关键,熟悉各个实验步骤的用途。
