(11分)某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。
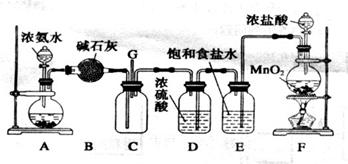
请回答下列问题:
(1)装置A中的固体物质不宜选用_______________(填字母编号)。
a.无水氯化钙 b.氢氧化钠 c.氧化钙 d.碱石灰 e.无水硫酸铜
(2)写出装置F中发生反应的离子方程式:
_______________________________________________________________________;
E装置的作用为________________________________________________________。
(3)通入C装置的两根导管左边较长、右边较短,原因是________________________
___________________________________________________________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。当有0.15molCl2参与反应时,则生成的气体在标准状况下的体积为____________。
(5)上述装置还存在一处明显的缺陷,你认为改进的措施是____________________
___________________________________________________________________________。
(1)a e(2分)
(2)MnO2+4H++2Cl— Mn2++Cl2↑+2H2O(2分,不写反应条件只给1分)
Mn2++Cl2↑+2H2O(2分,不写反应条件只给1分)
除去氯气中的氯化氢(1分)
(3)可使密度较大的氯气与密度较小的氨气能较快地均匀混合(2分)
(4)1.12L(2分)
(5)在G处连接一尾气处理装置(2分)
题目分析:(1)无水氯化钙会与氨气反应,不能选用;氢氧化钠吸水放热可以;氧化钙吸水放热可以;碱石灰可以;无水硫酸铜不能吸水放热,不行;
(2)装置F中是实验室制氯气的反应;MnO2+4H++2Cl— Mn2++Cl2↑+2H2O;E装置的作用为除去氯气中的氯化氢。
Mn2++Cl2↑+2H2O;E装置的作用为除去氯气中的氯化氢。
(3)可使密度较大的氯气与密度较小的氨气能较快地均匀混合。
(4)根据反应的方程式8NH3+3Cl2=6NH4Cl+N2。当有0.15molCl2参与反应时,则生成的氮气为0.05mol,在标准状况下的体积为1.12L。
(5)由于氯气、氨气有毒,污染环境,必须增加尾气处理装置。
点评:对于教材中的实验:氯气的制备、氨气的制取装置要熟练掌握。属于比较综合的中档题。
