A、D、E、M、L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物.回答下列问题:
(1)元素D在元素周期表中的位置是______.
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为______.
(3)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为______.(填化学式)
(4)设化合物甲、乙、丙分别为DA3EA、DA3EDA3、A2E.
ⅰ:已知:(1)丙(g)═丙(l)△H=-Q1 kJ•mol-1
(2)2甲(l)+3E2(g)═2DE2(g)+4丙(g)△H=-Q2 kJ•mol-1
Q1、Q2均大于0.若要使32g液态甲完全燃烧并恢复到室温,放出的热量为______.
ⅱ:已知:2甲(g)=乙(g)+丙(g).在某温度下,在1L密闭容器中加入甲,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol•L-1 | 0.01 | 0.2 | 0.2 |
②10min内平均反应速率v(甲)=______.
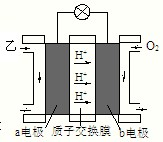
ⅲ:如图是乙为燃料的绿色电源工作原理示意图.若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:______.
A是元素周期表中原子半径最小的元素,应为H元素;D的某种单质是天然存在的最硬物质,应为C元素;E是地壳中含量最多的元素,应为O元素;M与A位于同一主族,且原子序数大于O,应为Na元素;L与M能够形成ML型离子化合物,且L的原子序数最大,应为Cl元素,则
(1)D为C元素,原子序数为6,原子核外有2个电子层,最外层电子为4,应位于周期表第二周期第IVA族,
故答案为:第二周期第IVA族;
(2)L的单质为Cl2,M为Na元素,对应的最高价氧化物为NaOH,二者反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)物质的量浓度相同的MEA、MADE3、MLE三种溶液分别为NaOH、NaHCO3、NaClO,NaOH为强碱,抑制水的电离,
NaHCO3、NaClO为强碱弱酸盐,发生水解,促进水的电离,由于碳酸的酸性比HClO强,则NaClO水解程度较大,水的电离程度较大,
则有水的电离程度由大到小的顺序为NaClO>NaHCO3>NaOH,
故答案为:NaClO>NaHCO3>NaOH;
(4)ⅰ:甲、乙、丙分别为CH3OH、CH3OCH3、H2O,则
(1)H2O(g)═H2O(l)△H=-Q1 kJ•mol-1
(2)2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-Q2 kJ•mol-1,
利用盖斯定律将(1)×4+(2)可得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-(4Q1+Q2)kJ•mol-1,
32g液态CH3OH的物质的量为n(CH3OH)=
1mol,32g 32g/mol
所以1molCH3OH完全燃烧并恢复到室温,放出的热量为0.5mol×(4Q1+Q2)kJ•mol-1=(2 Q1+0.5 Q2)kJ,
故答案为:(2 Q1+0.5 Q2)kJ;
ⅱ:①已知:2CH3OH(g)=CH3OCH3(g)+H2O(g),
则k=
=c(H2O)×c(CH3OCH3) c2(CH3OH)
=400,故答案为:400;0.2×0.2 (0.01)2
②v(CH3OH)=2v(CH3OCH3)=2×
=0.04 mol•L-1•min-1,故答案为:0.04 mol•L-1•min-1;0.2mol/L 10min
ⅲ:b电极为原电池的正极,a为原电池的负极,(CH3)2O被氧化生成二氧化碳,电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,
故答案为:(CH3)2O-12e-+3H2O=2CO2+12H+.