无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。
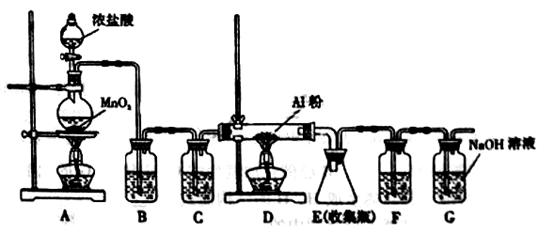
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是 。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式: 。
(3)装置B和C中的试剂分别是 。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是 。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因 。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的浓度,某同学量取残余液10.00mL,加水稀释到250.00mL。然后从中取出20.00mL,用0.1000mol·L-1的NaOH标准溶液进行滴定,终点时消耗NaOH溶液24.00mL。则该残余液体中盐酸的浓度为 。
(每空2分,共12分)
(1) acbd(2)MnO2 + 4HCl(浓) MnCl2+ Cl2↑+ 2H2O
MnCl2+ Cl2↑+ 2H2O
(3)饱和食盐水(水)、浓硫酸 (4)碱石灰或氧化钙
(5)AlCl3+3H2O= Al(OH)3+3HCl
(6)3.00 mol/L
题目分析:(1)装置气密性检验完以后,要首先加入固体二氧化锰,然后加入浓盐酸。由于金属铝是活泼的金属,极易被氧化,所以首先点燃A处酒精灯,然后点燃D处酒精灯,即正确的操作顺序是acbd。
(2)A装置是制备氯气的,则A装置中发生反应的化学方程式MnO2 + 4HCl(浓) MnCl2+ Cl2↑+ 2H2O。
MnCl2+ Cl2↑+ 2H2O。
(3)由于生成的氯气中含有氯化氢和水蒸气,会干扰氯化铝的制备,相应除去,则B中盛放饱和食盐水,用来除去氯化氢,C中盛放浓硫酸,用来干燥氯气。
(4)因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰来代替F和G的作用。
(5)由于氯化铝极易水解生成氢氧化铝和氯化氢,而氯化氢溶液形成白雾,反应的化学方程式是AlCl3+3H2O= Al(OH)3+3HCl。
(6)根据方程式HCl+NaOH=NaCl+H2O可知,盐酸的浓度是 =3.00mol/L。
=3.00mol/L。
