(14分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
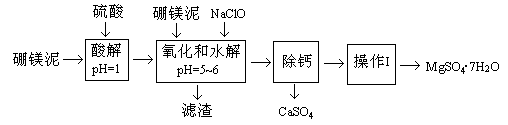
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。
(1)烧杯、100mL的容量瓶、胶头滴管 (2分) (2)SiO2(2分)
(3)Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl- (2分)
2Fe2+ + ClO- + 2H+ → 2Fe3+ + Cl- + H2O (2分)
(4)取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。 (2分)
(5)蒸发浓缩,趁热过滤 (2分) (6)80% (2分)
题目分析:1、配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,
2、由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
3、Mn2+与ClO-反应生成了MnO2沉淀H+和 Cl-。
Fe2+在酸性条件下被ClO-氧化为Fe3+、Cl-和 H2O。
4、取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
5、观察图表可以知道两种物质随着温度的升高溶解度一种增大一种减小,可以利用溶解度的不同来分离。
6、根据元素守恒可以计算出硼镁泥中镁的质量,在计算出196.8 g MgSO4·7H2O中镁的质量就可以计算出其产率了。
点评:本题属于简单题,难度不大,但是知识点较多,做题时先分析图表,了解每一步的设计作用,再进行做题。
