现有元素周期表中前20号五种元素:A、B、C、D、E,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.9g D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)写出各元素符号:
A______,B______,C______,D______,E______.
(2)B、D的最高价氧化物对应水化物相互反应的离子方程式为:______.
(3)用电子式表示C与E形成E2C的过程:______.
现有元素周期表中前20号五种元素:A、B、C、D、E.A的原子核中没有中子,则A为氢元素;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5,令B、C质子数分别为x、y,则x+y=27,y-x=5,解得x=11,y=16,故B为钠元素,C为硫元素;0.9g D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气,令D的相对分子质量为z,则
×3=0.9 z
×2,解得z=27,则D为铝元素;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构,E形成+1价离子,离子核外有18个电子,则E为钾元素,故A为氢元素;B为钠元素;C为硫元素;D为铝元素;E为钾元素.1.12L 22.4L/mol
(1)由分析可知,A为H元素;B为Na元素;C为S元素;D为Al元素;E为K元素,故答案为:H;Na;S;Al;K;
(2)B、D的最高价氧化物对应水化物为NaOH、Al(OH)3,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,二者相互反应的离子方程式为OH-﹢Al(OH)3=AlO2-﹢2H2O,
故答案为:OH-﹢Al(OH)3=AlO2-﹢2H2O;
(3)K2S是离子化合物,由钾离子与硫离子构成,用电子式表示K2S的形成过程为
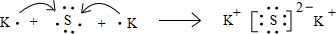
,
故答案为:
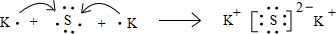
.
