(10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓)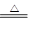 MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
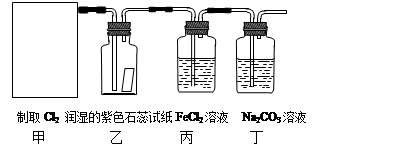
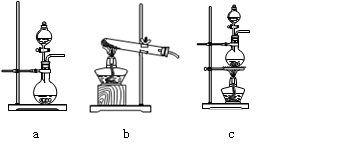
⑴在该实验中,甲部分的装置是 (填写字母)。
⑵乙装置中可观察到的颜色变化为: 。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是 。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
⑸该实验存在明显的缺陷,改进的方法是 。
⑴ c ⑵先变红,后褪色 ⑶2Fe2++Cl2 ="==" 2Fe3++2Cl-
⑷Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3
⑸在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶(合理即得分) (每空2分)
题目分析:(1)甲装置为氯气的制备装置,而氯气的发生装置为“固液加热型装置”,因此选c。
(2)氯气溶于水后能生成盐酸和次氯酸。盐酸具有酸性,可使石蕊试纸变红;而次氯酸具有氧化性,能使红色褪色。因此现象为“先变红,后褪色”。
(3)离子方程式为2Fe2++Cl2 ="==" 2Fe3++2Cl-
(4)根据质量守恒定律可得出方程式如下:Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3。
(5)氯气是一种有毒气体,不能直接排放到空气中,应将其通入碱溶液中,防止空气污染。
点评:本题以实验题的形式综合考查了氯气的相关知识,属于中档题。考生复习时,应加强对相关知识的联系,形成知识网络系统。
