(14分)某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
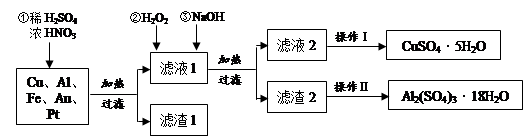
(1)在金属混合物与酸的反应中,表现氧化性的离子为 ;得到滤渣1的主要成分为 。
(2)第②步加H2O2后发生反应的离子方程式为 ;
通过加入NaOH调节溶液的pH,其目的是 ;
(3)操作Ⅰ中包括的实验步骤有 、过滤;
(4)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3·18H2O 。下列是操作Ⅱ的一种实验方案。

实验中:试剂1是 ,试剂2是 。(填化学式)
19.(14分)
⑴NO3- Au、Pt ⑵2Fe2++H2O2+2H+ = 2Fe3++2H2O 使Al3+ 、Fe3+转化为沉淀
⑶蒸发、冷却结晶 ⑷H2SO4 Al (每空2分)
题目分析:在酸性环境中硝酸根离子具有氧化性,只有Au、Pt不能溶于酸和碱,所以滤渣主要成分是Au、Pt,加入过氧化氢能将溶液中的亚铁离子完全氧化为铁离子,加入氢氧化钠调节溶液的pH来使铁离子和铝离子完全沉淀分离出来,滤液2为硫酸铜溶液进行蒸发结晶就可以得到硫酸铜晶体,滤渣2中含有氢氧化铁和氢氧化铝沉淀,加入硫酸可以使其完全溶解,再加入铝可以置换出硫酸铁中的铁,生成了铁单质和硫酸铝。
点评:本题难度中等,主要考察了常见金属的性质及一些化学实验操作,属于性质实验的考查,首先要先理解题意,然后观察实验装置,并分析每一个实验装置的设计意图,再结合实际的化学反应来对现象进行推测。
