A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,且C与E同主族;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红.
(1)E的元素名称是______.该元素在周期表中的位置为______
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)______;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为______
(3)写出D2C2的电子式______.用电子式表示只含D、E两种元素的化合物的形成过程______
(4)写出D2C2与H2O反应的离子方程式______.
根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素.
(1)E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,位于周期表第三周期VIA族,
故答案为:硫;第三周期VIA族;
(2)A、B、C分别为C、N、O元素,同一周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增大,A、B、C的氢化物稳定性由弱到强的顺序为CH4<NH3<H2O,B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z为NH4NO3,为离子化合物,含有离子键、极性键,故答案为:CH4<NH3<H2O;离子键、极性键;
(3)Na2O2为离子化合物,电子式为
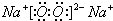
,D和E形成的化合物为Na2S,为离子化合物,用电子式表示的形成过程为
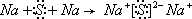
,故答案为:
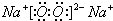
;
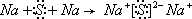
;
(4)Na2O2与水反应生成NaOH和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
